1.- Anestésicos locales:
-
Lidocaína: Bloquea los canales de sodio, evitando la despolarización neuronal. Su uso se remite a la circuncisión.
-
EMLA: Ungüento de lidocaína 2,5% y prilocaína 2,5%. Su uso es tópico, sobre piel intacta. Reduce el dolor en punción venosa, punción lumbar, inserción y retiro de tubo pleural. Vacunas y circuncisión. No es efectiva para punción de talón. El riesgo de metahemoglobinemia no es significativo respetando la dosis máxima (1g). El uso en prematuros (< 37 semanas) no se recomienda por falta de estudios.
2.- Analgésicos no opiáceos:
-
Paracetamol: Bloquea la síntesis de prostaglandinas a nivel central (COX2b y COX3). Utilizado ante dolor leve, como antipirético, y para el dolor postoperatorio no inmediato. No es útil en punciones.
-
AINES: Bloquean la síntesis sistémica de prostaglandinas (COX1 y COX2). Su uso actual se remite al ibuprofeno e indometacina para tratamiento del ductus arterioso persistente, debido a sus efectos adversos (renales, plaquetarios, mucosas, hemorragia intracerebral).
3.- Analgésicos opiáceos:
-
Actúan sobre receptores µ, o y K opioides, que a su vez actúan mediante proteínas Gi (inhibidoras), generando hiperpolarización neuronal y menor liberación de neurotransmisores. Utilizados para dolor moderado a severo (procedimientos invasivos, ventilación mecánica, postoperatorio). Tienen propiedades ansiolíticas y relajantes. Como desventaja tienen efectos hemodinámicos (hipotensión), respiratorios (obstrucción bronquial por liberación de histamina), y una elevada unión a albúmina. Logran reducir los seores de dolor y mejoran la sincronía en VM, pero aumentan su duración y no disminuyen la mortalidad. Aún no hay evidencia suficiente para recomendar su uso.
-
Morfina: libera histamina en mayor proporción, con mayor riesgo de hipotensión, bradicardia y broncoespasmo. Metabolización hepática (inmadurez en prematuros). Mejor potencia analgésica y sedación. Intolerancia alimentaria y constipación. Peak 45-90'. Duración 4-5 horas.
-
Fentanyl: 50-100 veces más potente que la morfina. Tiene efecto rápido y breve .. Es el que preserva mejor la hemodinamia. Sus desventajas son la rápida aparición de tolerancia, el riesgo de tórax rígido, y la baja sedación. Muy lipofílico (atraviesa BHE). Peak 3-4'. Duración 30'.
-
Remifentanyl: "Nuevo" opiáceo. Efecto rápido y breve (intubación). Metabolismo por estearasas plasmáticas. Peak 1 '. Duración 5-1 O'.
-
Metadona: Analgésico potente, inicio rápido y acción prolongada. Buena biodisponibilidad por vía entera!. Bajo costo.
4.- Benzodiazepinas:
-
Ansiolíticos utilizados para proveer sedación, relajación muscular y amnesia, pero proveen poca analgesia. Actúan inhibiendo el receptor GABA. Efectos adversos incluyen mioclonías, sedación excesiva, depresión respiratoria y ocasionalmente hipotensión.
-
Midazolam:
-
Es la benzodiazepina más usada en UCIN.
-
Genera mayor sedación al usarse en conjunto comparado con morfina sola, sin aumentar los efectos adversos.
-
Al usarse como sedante único, generaría más efectos adversos comparado con opiáceos (NOPAIN: HIV, LMPV, muerte, estadía hospitalaria). Además se genera una exposición riesgosa a alcohol bencllico.
-
Por último, debido a su metabolismo hepático por glucuronidación, interfiere con el metabolismo de la bilirrubina (especialmente en el asfixiado o prematuro).
-
Por lo anterior, no se recomienda el midazolam como sedante de rutina.
-
-
Lorazepam:
-
Tiene vida media mayor (8-12 hrs), por lo que no es necesario su uso en infusión continua.
-
Se utiliza en convulsiones neonatales como segunda o tercera línea. Se ha asociado a exposición a propilenglicol.
-
5.- Barbitúricos
-
El fenobarbital es considerado la primera línea en el tratamiento de las convulsiones neonatales. Sin embargo, su uso como sedante, analgésico y para el síndrome de abstinencia neonatal ha sido cuestionado por la evidencia.
6.- Hidrato de cloral
-
Es utilizado cuando se requiere sedación (sueño), sin analgesia, como en procedimientos imagenológicos o EEG.
-
Es convertido a tricloroetanol, que es metabólicamente activo.
-
Existen reportes de desaturación en prematuros y RN de término menores de un mes que lo recibieron para resonancia magnética, por lo que requiere monitorización.
7.- Propofol.
-
Ha crecido su uso como analgésico, principalmente para intubación, logrando mayor efectividad con menos efectos adversos.
-
Sin embargo, en prematuros su farmacocinética es errática, por lo que debe usarse con precaución.
8.- Ketamina
-
Anestésico disociativo, provee analgesia, sedación y amnesia.
-
Genera un leve aumento de la presión sanguínea y frecuencia cardiaca, con mínimo efecto sobre la circulación cerebral, por lo que sería una buena alternativa en el paciente hemodinámicamente comprometido que requiere de procedimientos invasivos.
-
La falta de estudios hace mantener esta medicamento como una alternativa a usar con precaución.
Síndrome de abstinencia neonatal:
Ante la inminente complejización del paciente neonatal (falla respiratoria severa, cirugías complejas, ECMO, etc.) la exposición prolongada y en dosis elevadas a sedoanalgesia se ha vuelto frecuente, y con ello, el síndrome de dependencia adquirido a opioides y benzodiazepinas. Este se caracteriza por la presencia de tolerancia (necesidad de aumentar progresivamente las dosis para lograr el mismo efecto) y abstinencia (signos y síntomas que aparecen ante la disminución o suspensión brusca de la droga). Hoy se presenta incluso sobre el 50% de los pacientes UCIN. Debe recordarse que gran parte de estos conocimientos provienen del síndrome de abstinencia neonatal, donde el recién nacido presenta síntomas secundarios al consumo materno de drogas durante el embarazo.
Los mecanismos de tolerancia conocidos incluyen desensibilización del receptor opioide (por downregulation, internalización o desacoplamiento de proteína G¡) y upregulation de AMPc (por sensibilización de AMPc o acoplamiento a proteína Gs (estimulante)). Estos procesos son mediados por protein-kinasas. Factores de riesgo para tolerancia son: La duración de la ocupación del receptor (>5 días), la dosis total acumulada (>1,6 mg/kg), la capacidad tolerogénica intrínseca del opioide (sintéticos>naturales, o fentanyl >morfina >metadona), prematurez (generan metabolito antianalgésico), sexo masculino.
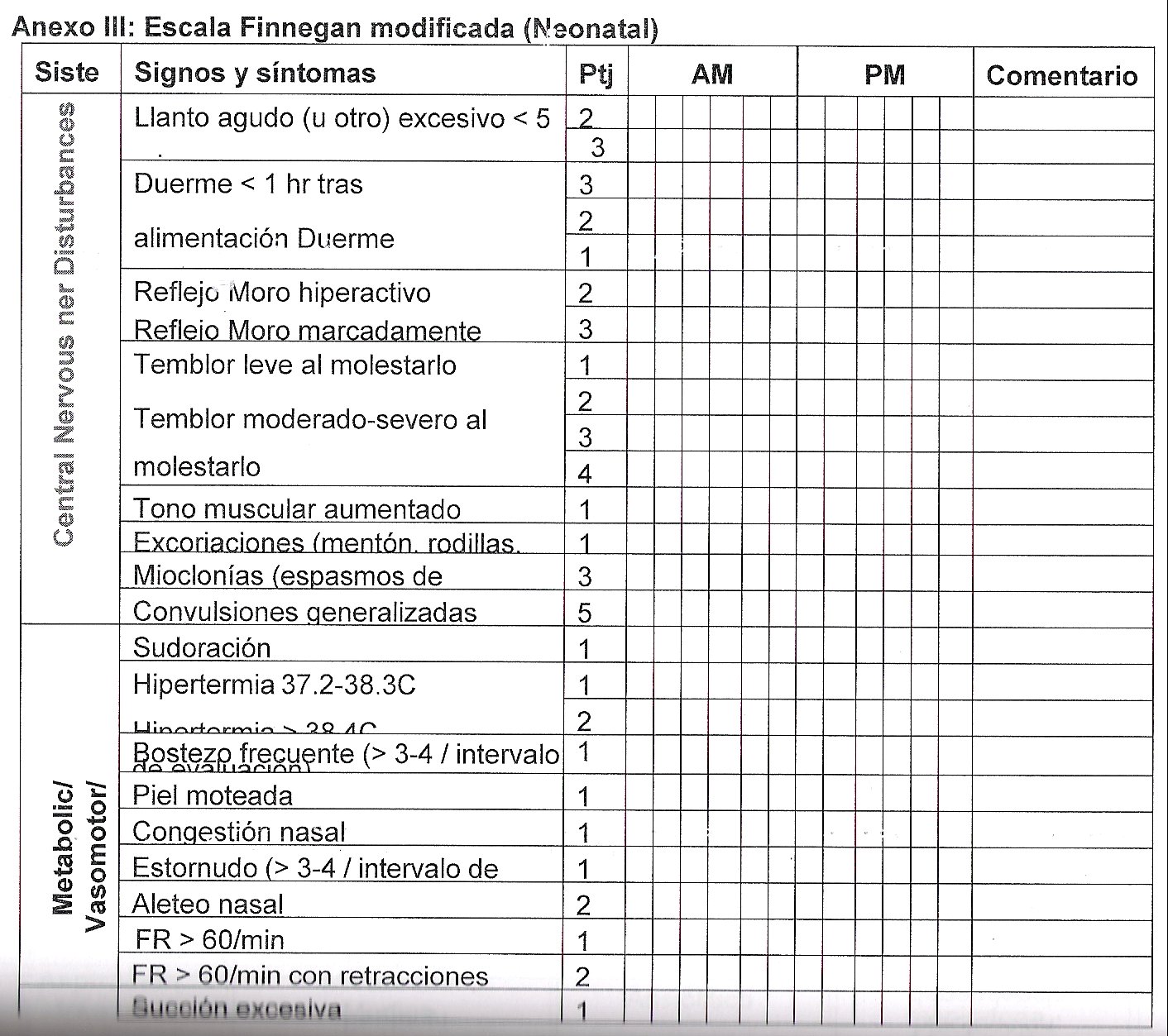
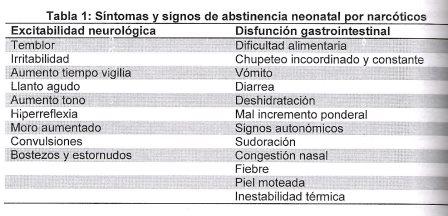
La presentación clínica incluye signos y síntomas neurológicos, gastrointestinales y autonómicos (Tabla 1). Se debe mantener un alto índice de sospecha, ya que estos síntomas son inespecíficos, traslapándose con los de pacientes graves. No existe una escala universalmente aceptada, siendo importante la aplicación constante de la misma herramienta en cada unidad, como por ejemplo la escala Finnegan (Anexo///).
Tabla 1: Síntomas y signos de abstinencia neonatal por narcóticos
La prevención debe considerar el uso adecuado de sedoanalgesia, es decir, la dosis mínima efectiva, por el tiempo mínimo necesario. Según lo anteriormente señalado, esto se logra mediante la revisión periódica del esquema y dosis utilizados, además de favorecer terapias poco invasivas (Ej. VMNI). El manejo incluye medidas ambientales (estímulo mínimo), protocolos de destete y terapias farmacológicas coadyuvantes, entre estas últimas la infusión concomitante de opioides con ketamina o naloxona, aunque se encuentran en fases experimentales.